Celda electroquímica descripción y funcionamiento
Las celdas electroquímicas utilizan reacciones químicas para generar energía eléctrica o, alternativamente, utilizar la energía eléctrica para conducir reacciones químicas. También son herramientas importantes en química para la medición de los potenciales de reducción de diferentes sustancias. Las baterías son un ejemplo de las celdas electroquímicas. La construcción de un tipo de celda electroquímica llamada celda Daniell es un experimento simple de química que se puede hacer en casa, aunque es importante seguir las precauciones de seguridad adecuadas cuando lo hace para evitar cualquier riesgo para usted o para otros.
Es Alessandro Volta en Italia que inventó la batería por primera vez en 1800. Utilizó el zinc y cobre en ácido sulfúrico diluido. Esta celda eléctrica es un prototipo de una pila seca en la actualidad.
Funcionamiento de una celda voltaica
Una celda voltaica es una celda electroquímica que utiliza una reacción química para producir energía eléctrica. Las partes importantes de una pila voltaica: el ánodo es un electrodo donde ocurre la oxidación. El cátodo es un electrodo en donde se produce la reducción.
Para hacer una pila voltaica se nacesitan distintos materiales.
Materiales como: vasos de vidrio o botellas de vidrio, ácido sulfúrico diluido (líquido de la batería), placa de zinc, placa de cobre, cable conductor, diodo emisor de luz (LED), y la solución de peróxido de hidrógeno.
Una celda voltaica consiste en dos electrodos, uno de cobre y el otro de zinc por inmersión en una solución de ácido sulfúrico diluido en un recipiente de vidrio. En la conexión de los dos electrodos externamente, con un trozo de alambre, la corriente fluye desde el cobre al cinc fuera de la celda y de zinc a cobre en su interior.
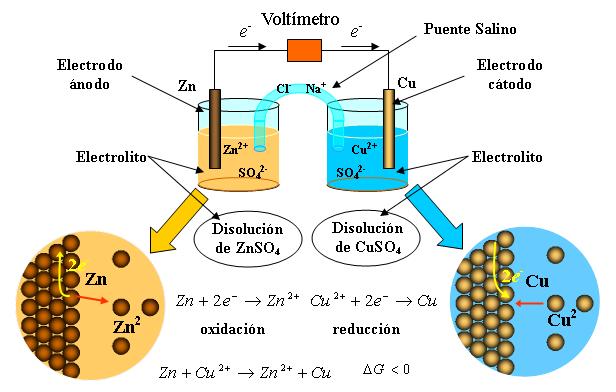
El número de electrones transferidos en ambas direcciones debe ser el mismo; así las dos semiceldas se combinan para dar la reacción electroquímica global de la celda. Para 2 metales, A y B.
